Очистка газов дожиганием в пламени
Если загрязняющие вещества легко окисляются, как, например, пары углеводородов в отходящих газах цехов растворителей или красок, то их удаление может быть осуществлено путем сжигания газов, причем образуются диоксид углерода и вода при сжигании углеводородов, или диоксид серы и вода - в случае органических сульфидов. Если концентрация этих примесей в газах достаточно велика и входит в область воспламеняемости, после первоначального поджигания будет поддерживаться процесс самоокисления. Самая низкая концентрация паров, при которой происходит этот процесс, является нижним пределом воспламеняемости, а самая высокая - верхним пределом воспламеняемости. В этих пределах может происходить регулируемое сжигание, однако в некоторых условиях возможен взрыв.
Температура, выше которой горение газов или паров поддерживается произвольно, называется температурой самовоспламенения и зависит от углеводорода и количества тепла, выделяющегося в процессе горения (чистая доступная теплота сгорания в расчете на стандартный кубометр газа, Дж/м3 при 21°С). Нижний предел горения составляет приблизительно 1,9 МДж/м3 при 21°С, поэтому для самоподдерживающегося горения необходимо тепло более этой величины; для пламени с хорошими параметрами горения желательно тепловыделение более, чем 3,7 МДж/м3 (21°С).
Для поддержания любого процесса горения необходимо соответствующее количество кислорода. При обычном сжигании необходимое количество кислорода на 1015% больше стехиометрического, тогда как в процессах каталитического сжигания требуется только стехиометрическое количество. Кроме того, чтобы температура в камере сжигания или в пламени была достаточно высокой, необходимо интенсивное турбулентное перемешивание кислорода и сжигаемого газа и обеспечить достаточное время пребывания для полного сжигания. Эти факторы определяются конструкцией горелки и камеры сжигания, а также степенью предварительного смешивания газов.
Факел заранее перемешанной смеси короче, горячее и обычно голубого цвета, тогда как факел неперемешанных газов обычно очень яркий, что объясняется крекингом углеводородов и образованием раскаленных частиц углерода.
Основная химическая реакция окисления любого углеводорода
СmНn:
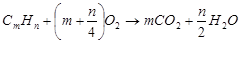
Выделяющееся тепло ΔH является энтальпией, или теплотой реакции при постоянном давлении. Второй закон термодинамики связывает ее с энергией Гиббса ΔG уравнением
ΔG = ΔH-TΔS,
где ΔS - изменение энтропии, Т - абсолютная температура.
Значения этих функций при 25°С и 101325 Па называются стандартными и обозначаются ΔG, ΔH°, ΔS°. Для отрицательных значений ΔG реакция термодинамически возможна, тогда как для значений ΔG от 0 до 42000 Дж/кмоль вероятность самопроизвольной реакции невелика, однако этот вопрос заслуживает дополнительного исследования. При ΔG>42000 Дж/кмоль самопроизвольная реакция невозможна.
Константу равновесия реакции (5.1) можно записать
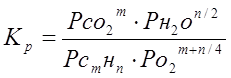
где р - парциальные давления веществ.
Некоторые типичные значения ΔH°, ΔG° (в МДж/кмоль) и lgKp для окисления формальдегида (НСНО), пропана (C3H8) и этанола приведены ниже:
|
|
| |
| НСНО | -579,9 | -512,8 |
| C3Н8 | -2044,9 | -2075,0 |
| С2Н5ОН | -2991,7 | -3020,6 |
Другие статьи
Мониторинг природных ресурсов Термин «мониторинг» образован от латинского слова «monitor» (напоминающий, надзирающий) и обозначает процесс слежения за какими-то объектами или процессами. Мониторинг - комплексная система наблюдения, оценки и прогноза состояния природной среды, основа планомерного у ...